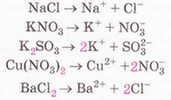1. Електролітична дисоціація кислот
Вам відомо, що речовини, що здатні дисоціювати у водних розчинах або розплавах, називають електролітами. До них належать кислоти, луги, солі. Розглянемо особливості їхньої дисоціації.
Запишемо рівняння електролітичної дисоціації кислот:
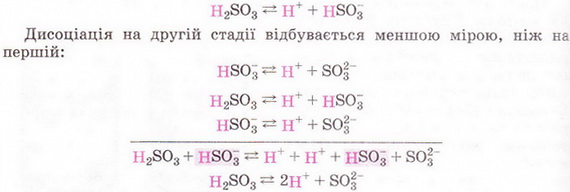
Кислотні залишки в різних кислот різні, проте спільною ознакою всіх кислот є наявність в їхніх розчинах гідратованих катіонів Гідрогену Н3О+ (у рівняннях для спрощення пишемо Н+).
Кислотами називають електроліти, при дисоціації яких у водних розчинах утворюються катіони тільки одного типу — гідратовані йони Гідрогену.
Наявність катіонів Гідрогену в розчинах кислот зумовлює їхні загальні властивості: кислий смак, загальні хімічні властивості, дію на індикатори. Усі кислоти однаково змінюють забарвлення індикаторів у своїх розчинах.
За числом катіонів Гідрогену, що утворюються в результаті дисоціації однієї молекули кислоти, визначають основність кислоти. Хлоридна HCl і нітратна HNO3 кислоти є одноосновними. Сульфатна кислота H2SO4 — двохосновна, а ортофосфатна кислота H3PO4 — трьохосновна:
Багатоосновні кислоти дисоціюють ступінчасто, поступово відщеплюючи по одному катіону Гідрогену. Дисоціація за першим ступенем зазвичай відбувається більшою мірою, ніж за другим
2. Електролітична дисоціація основ
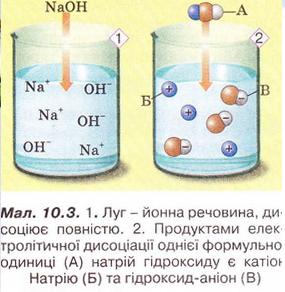
Лугами називають електроліти, при дисоціації яких у водних розчинах утворюються тільки гідроксид-аніони.
Наявність гідроксид-аніонів у розчинах лугів зумовлює їхні загальні властивості: милкість на дотик, руйнівний вплив на шкіру, папір, волосся тощо, дію на індикатори.
Луги — йонні речовини, тому їхня дисоціація є повною.
NaOH → Na+ + ОН-,
Ва(ОH)2 ->Ва2+ + 2OH-
3. Електролітична дисоціація солей
Солями називають електроліти, при дисоціації яких у водних розчинах утворюються гідратовані катіони металічних елементів та аніони кислотних залишків.
Cолі — йонні речовини, тому їхня дисоціація є повною.
Заряд катіонів металічних елементів у багатьох випадках можна визначити за Періодичною системою хімічних елементів. Заряди йонів металічних елементів головних підгруп зазвичай дорівнюють номеру групи, у якій розміщений елемент. Металічні елементи побічних підгруп зазвичай утворюють кілька йонів, наприклад: Fe2+, Fe3+.
4. Властивості кислот, основ і солей з погляду теорії електролітичної дисоціації
|
Електроліти |
Йони, що утворюються при дисоціації |
Характерні властивості |
|
Кислоти |
H+ |
Діють на індикатори та реагують з йонами ОН– з утворенням води: Н+ + ОН– = Н2О |
|
Основи |
ОН– |
Діють на індикатори і реагують з йонами Н+ з утворенням води: ОН– + Н+ = Н2О |
|
Солі |
Катіони металічних елементів та аніони кислотних залишків |
Відсутні загальні властивості, що зумовлено наявністю різних йонів |
Йонні рівняння. Складання йонних рівнянь.
► Виконання завдань для закріплення знань
1. Допишіть рівняння можливих реакцій, напишіть повні та скорочені йонні рівняння цих реакцій. У кожному випадку назвіть ознаку реакції, за якою можна судити про можливість її перебігу.
Варіант1: а) ВаС12 + МgS04 -> б) NaNО3 + МgС12 ->
Варіант 2: а) Ва (ОН)2 + Nа2S04 -> б) FеС12 + NaOН ->
Варіант 3: а) Н2S04 + РЬ(NO3)2 -> б) ZnС12 + NaN03 ->
2. Допишіть молекулярні рівняння реакцій, складіть повні та скорочені йонні рівняння.
Варіант1:
а) ферум(ІІ) гідроксид + хлороводнева кислота —> ... + ...
б) нітратна кислота + калій гідроксид —>... + ...
Варіант 2:
а) натрій сульфіт + хлороводнева кислота —>... + ...
б) натрій гідроксид + сульфатна кислота —>
Варіант 3:
а) калій карбонат + нітратна кислота —> ... + ...
б) нікель(ІІ) хлорид + калій гідроксид —> ... + ...
► Виконання завдань на застосування знань у змінених умовах
1. Закінчіть молекулярні рівняння реакцій, складіть повні та скорочені йонні рівняння.
Варіант1:
а) калій сульфат + ... —> барій сульфат + ...
б) барій хлорид + ... —> барій карбонат + ...
Варіант 2:
а) аргентум нітрат + ... —> аргентум хлорид + ...
б) натрій сульфід + ... —> плюмбум сульфід + ...
Варіант 3:
а) натрій сульфід + ... —> сірководень + ...
б) натрій бромід + ... —> аргентум бромід + ...
2. Допишіть рівняння реакцій, запишіть їх у повному і скороченому йонному вигляді.
Варіант1: а) МеS04 + ... —> … ↓+ К 2S04
б) FeS + ... = FеСІ 2 + ... ↑
Варіант 2: а) ... + НС1 = ... ↓ + HNO3
б) ... + ... = Fе(ОН)2 ↓ + ВаS04↓
Варіант 3: а) ... + Н2S04 = ... ↓ + НС1;
б) Nа3PO4 + ... = …↓ + NаСІ.
Чи мають ці завдання тільки один розв'язок?
3. Випишіть із переліку формули солей, які взаємодіють із хлоридною кислотою
КВг, АgNО3, СаС03, МgS04. Напишіть рівняння реакцій у молекулярному, повному і скороченому йонному вигляді.
► Виконання завдань на творче застосування знань
1.Наведіть по два рівняння реакцій, що відповідають такому скороченому йонному рівнянню:
а) Ва2+ + S02- = ВаS04 г) А13+ +ЗОН- =А1(ОН)3
б) Н+ +ОН- =Н20; д) Са2+ + СО32- = СаСО3
в)2Н+ + S032- =S02 + Н2О.
2. Наведіть по одному рівнянню, що відповідають кожній схемі реакції,
напишіть скорочене йонне рівняння для кожної реакції:
а) сіль + сіль = сіль + сіль;
б) сильна кислота + сильна основа = сіль + вода;
в) слабка кислота + сильна основа = сіль + вода;
г) сильна кислота + слабка основа = сіль + вода;
д) сильна кислота + сильна основа = сіль + вода;
є) сіль + сильна кислота = сіль + слабка кислота.