Хімічні властивості кисню
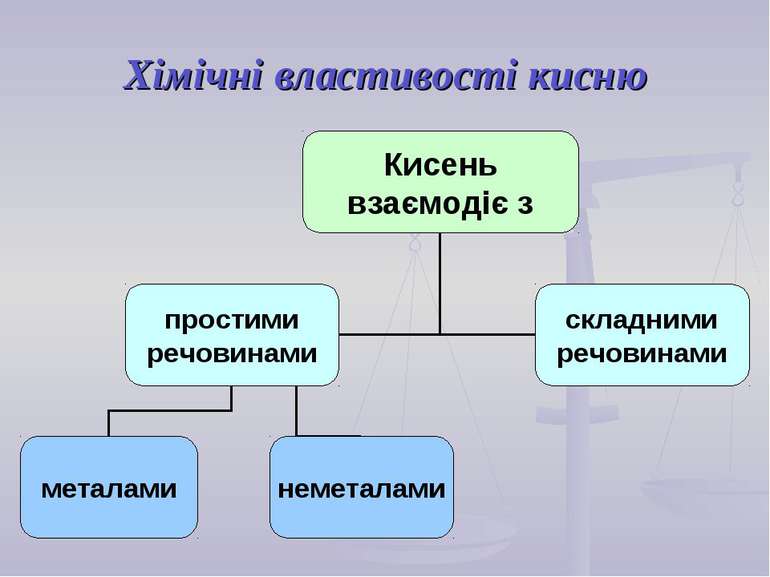
За звичайних умов кисень реагує з обмеженим числом речовин, але з підвищенням температури він реагує майже з усіма металами, а також більшістю неметалів, утворюючи складні речовини – оксиди:
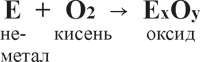 |
Е – умовний символ неметалічного елемента (S, P, N, H, Si, C);
Ме – умовний символ металічного елемента (K, Na, Zn, Ba, Mg, Fe, Al, Li, Ca та інші).
Дослідимо хімічні властивості кисню.
1. Взаємодія кисню з неметалами
1.1. Взаємодія кисню з фосфором (Р)
У залізну ложечку наберемо червоного фосфору і внесемо у полум’я спиртівки. Коли фосфор загориться – винесемо ложечку з полум’я: спостерігаємо процес горіння фосфору на повітрі.
У посудину з киснем внесемо залізну ложечку із запаленим фосфором. Утворюється густий білий дим. Це – тверді частинки нової речовини фосфор оксиду. Якщо після закінчення досліду в посудину внести жевріючу скіпку, то виявиться, що кисню в посудині більше немає.
Відбулася реакція між киснем і фосфором.
Щоб написати рівняння цієї реакції, необхідно знати формули речовин, які взаємодіють (реагентів) і речовин, які утворюються (продуктів реакції). Формули реагентів нам відомі: фосфор – Р і кисень – О2, а ось формулу продукту реакції потрібно скласти.
Неважко зрозуміти, що до складу утвореного оксиду входять лише два елементи: Фосфор і Оксиген.
Оскільки, валентність Фосфору – V, а Оксигену – II, то формула оксиду – P2O5. Рівняння реакції матиме такий вигляд:
4Р + 5О2 = 2Р2О5 (фосфор(V) оксид).

Горіння фосфору в кисні.
1.2. Взаємодія кисню з вугіллям (С)
Покладемо в залізну ложечку шматочок вугілля і внесемо у посудину з киснем. Холодне вугілля не взаємодіятиме з киснем. Але якщо його розжарити, а потім внести у посудину з киснем, то відбуватиметься інтенсивне горіння. Щоб скласти формулу добутого карбон оксиду, міркуємо так: оскільки валентність Карбону змінна (II, IV), а Оксигену – стала (ІІ), то можливе утворення двох речовин: СО і СО2.
Щоб з’ясувати, яка з речовин (СО чи СО2) утворилась, додамо вапняної води у посудину, в якій горіло вугілля, і збовтаємо її. Якщо спостерігається помутніння, то у посудині утворився вуглекислий газ (СО2). Тому реакцію горіння вугілля записуємо у вигляді:
С + О2 = СО2 (карбон(ІV) оксид).

Горіння вугілля на повітрі і в кисні.
1.3. Взаємодія кисню із сіркою (S)
Покладемо у залізну ложечку шматочок сірки і внесемо в полум’я спиртівки. Коли сірка загориться, винесемо ложечку з полум’я: спостерігаємо процес горіння і відмічаємо запах виділеного газу. На повітрі сірка горить невеликим синюватим полум’ям. Опустимо ложечку із запаленою сіркою в кисень. Сірка розгоряється гарним, синім полум’ям, при цьому утворюється газ із різким запахом – сульфур(IV) оксид:
S + O2 = SO2 (сульфур(ІV) оксид).

Горіння сірки на повітрі і в кисні.
2. Взаємодія кисню з металами
Кисень взаємодіє з металами. Одні метали в кисні горять як от залізо, магній, а інші – окиснюються.
2.1. Взаємодія кисню з магнієм (горіння магнію)
Насипаємо на металічну пластину порошок магнію. Вставляємо в утворену купку порошку 3 головки сірників і запалюємо їх: магній горить на повітрі яскравим засліплюючим полум’ям з виділенням теплоти і світла. Цю реакцію використовують у фейєрверках.

Горіння магнію.
2.2. Взаємодія міді й алюмінію з киснем
Мідна спіраль у кисні розжарюється, але не горить, а покривається чорним нальотом купрум(ІІ) оксиду: 2Cu + O2 = 2CuO (купрум(ІІ) оксид).
На відміну від міді, алюміній реагує з киснем навіть без нагрівання, з утворенням на своїй поверхні надзвичайно тонкої та стійкої оксидної плівки: 2Al + 3O2 = 2Al2O3 (алюміній оксид).
Аналогічно взаємодіють з киснем й інші прості речовини. Хімічні реакції кисню з простими речовинами відносять до реакцій окиснення, а утворені речовини – до оксидів.
Під час взаємодії кисню з простими речовинами відбувається сполучення їхніх структурних частинок з молекулами кисню:

3. Взаємодія кисню зі складними речовинами
3.1. За певних умов у кисні горять складні речовини:

Під час взаємодії складних речовин з киснем утворюються оксиди тих хімічних елементів, які входили до складу складної речовини.
Прикладом взаємодії кисню зі складними речовинами може бути горіння природного газу метану (СН4). При цьому утворюються дві речовини – вуглекислий газ і вода:
СН4 + 2О2 = СО2 + 2Н2О.
3.2.У деяких випадках під час горіння складних речовин можуть утворюватися оксиди і прості речовини:
4NH3 (амоніак) + 3O2 = CO2 + 2H2O .
3.3.Кисень взаємодіє з деякими оксидами. Це реакція сполучення. Продуктом такої реакції є інший оксид, у якому елемент виявляє вище значення валентності:
2CO + O2 = 2CO2;
2SO2 + O2 = 2SO3.
Підсумок
- Кисень – одна з найбільш хімічно активних простих речовин. Швидкість горіння речовин у чистому кисні більша, ніж у повітрі, тому що повітря містить домішки інших газів, які не беруть участі у реакції.
- Для виявлення кисню використовують жевріючу скіпку. Вона загоряється, якщо кисню в суміші міститься не менше 28%.
- Кисень підтримує горіння.
- Кисень взаємодіє з усіма металами, за винятком золота і платини і з неметалами, за винятком галогенів, з утворенням оксидів.
- У реакціях сполучення кілька речовин простішого складу утворюють одну більш складну речовину.
?????
- Чому в кисні речовини горять краще, ніж у повітрі?
- До якого типу належать реакції горіння і окиснення простих речовин?
- Які реакції називають реакціями сполучення? Наведіть приклади.
- Що ви знаєте про хімічні властивості кисню?
- Які речовини можуть утворюватися під час горіння складних речовин?
Домашній експеримент
Колір полум’я
 Деякі елементи забарвлюють полум’я в певний колір. Приготуйте розчини таких речовин: кухонної солі, мідного купоросу і вапняної води. Зробіть невеличку петлю на мідному або стальному дроті, довжина якого не менше 15 см. Кінець дроту із петлею прожарте у полум’ї газової плити (полум’я невеличке) і внесіть в розчин кухонної солі. Полум’я забарвлюється у гарний зелений колір, це свідчить про наявність Хлору. Прожарте дріт до зникнення забарвлення, вмокніть петлею у розчин вапняної води – внесіть у полум’я. Кальцій забарвить полум’я у цегляно-червоний колір. Повторіть дослід із розчином мідного купоросу. Купрум забарвлює полум’я у синьо-зелений колір.
Деякі елементи забарвлюють полум’я в певний колір. Приготуйте розчини таких речовин: кухонної солі, мідного купоросу і вапняної води. Зробіть невеличку петлю на мідному або стальному дроті, довжина якого не менше 15 см. Кінець дроту із петлею прожарте у полум’ї газової плити (полум’я невеличке) і внесіть в розчин кухонної солі. Полум’я забарвлюється у гарний зелений колір, це свідчить про наявність Хлору. Прожарте дріт до зникнення забарвлення, вмокніть петлею у розчин вапняної води – внесіть у полум’я. Кальцій забарвить полум’я у цегляно-червоний колір. Повторіть дослід із розчином мідного купоросу. Купрум забарвлює полум’я у синьо-зелений колір.
http://www.chemistry.in.ua/grade-7/chemical-properties-of-oxygen
Тестові завдання з теми "Кисень"
1.У якому з тверджень іде мова про хімічний елемент Оксиген:
1) входить до складу молекули води;2) газ без кольору та запаху;3) ним дихають риби.
2. У якому з тверджень йдеться мова про просту речовину – кисень:
1) його валентність рівна ІІ; 2) 85,7% його входить до складу гідросфери; 3) вступає в реакцію з різними речовинами.
3. Валентність Оксигену у сполуках дорівнює:
1) ІІІ 2) І 3) ІІ
4. Речовина, що прискорює швидкість хімічної реакції, але не входить до складу продуктів реакції називається:
1) оптимізатор; 2) каталізатор; 3) індикатор
5. Кисень за нормальних умов :
1) газ; 2) рідина; 3) тверда речовина.
6. В якому з варіантів серед сполук є тільки оксиди:
1) SO2, Al2O3, ZnO, Na2O, O2 2) KMnO4, K2O, FeO, Al2O3, KClO3 3) P2O5, CO, CO2, NO2, Mn2O7
7. Реакції, в результаті яких з кількох вихідних речовин (простих чи складних) утворюється одна складна речовина називаються:
1) реакції розкладу; 2) реакції сполучення; 3) реакції обміну
8. Знайти суму коефіцієнтів у рівняннях:
Fe + O2 → Fe3O4 P + O2 → P2O5
9. Як добувають кисень у промисловості:
1) розкладанням перманганату калію; 2) зрідженням повітря під тиском; 3) розкладанням пероксиду гідрогену.
10. Як перевірити наявність кисню:
1) внести залізну ложку; 2) внести тліючу скіпку; 3) внести свічку, що згасла.
11. Яку масову частку становить Оксиген у складі Al2O3
1) 25%; 2) 43%; 3) 47%









