Кожного дня вдома для приготування їжі ми використовуємо кухонну сіль NaCl. Питну соду NaHCO3 здавна застосовували для миття посуду та приготування смачної випічки. У школі неможливо обійтись без крейди, основна складова якої кальцій карбонат CaCO3. Усі ці сполуки належать до класу солей.
Солі — це складні речовини, що містять катіони металічних елементів та аніони кислотних залишків.
У формулах солей на першому місці пишуть символ металічного елемента, а потім кислотний залишок:

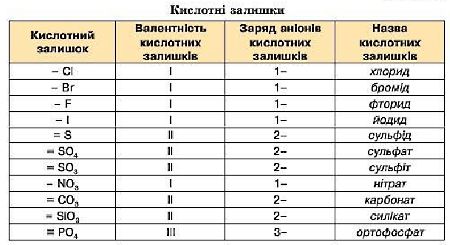
Назви солей складаються:
• для елементів зі сталою валентністю: 
• для елементів зі змінною валентністю: 
наприклад: FeSO4 — ферум (ІІ) сульфат, CuCl2 — купрум (ІІ) хлорид.
наприклад: K2SO3 — калій сульфіт, CaCO3 — кальцій карбонат;
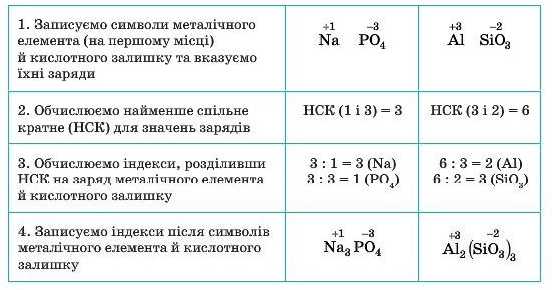
Формули солей складають аналогічно формулам оксидів, зрівнюючи заряди атомів металічного елемента й кислотного залишку.
Алгоритм складання формул солей (на прикладі натрій ортофосфату та алюміній силікату)
Виконай інтерактивну вправу: Назвати солі за їх хімічними формулами
Деякі солі, що широко використовуються в побуті, крім наукових, мають побутові (традиційні) назви. Наприклад, ви вже знаєте, що натрій хлорид NaCl називають кухонною або кам’яною сіллю, натрій карбонат Na2CO3 — це кальцинована сода, калій карбонат K2CO3 — поташ. Традиційні назви найбільш уживаних солей наведено в опорній схемі.
Поширення солей у природі
У природі солі є основною складовою більшості мінералів. Кухонна сіль — галіт; кальцій карбонат — мармур, вапняк, крейда; кальцій сульфат CaSO4 — гіпс та інші.
Солі відіграють важливу роль у процесах обміну речовин у живих організмах. Вони обов’язково присутні в м’язах, кістковій та нервовій тканинах. Наприклад, солі Калію відповідають за роботу серцевого м’яза. Натрію — за передавання нервового сигналу, завдяки чому організм сприймає інформацію ззовні та реагує на неї. Для росту кісток і зубів необхідні солі Кальцію.
Солі розчинені у клітинному сокові рослин. Недостатня кількість солей у ґрунтах знижує врожайність культур, тому сільське господарство використовує певні солі як мінеральні добрива.
Магнію, Цинку й інші. Деякі можуть бути забарвлені в різні кольори та відтінки: купрум(ІІ) сульфід CuS — чорний; нікель(ІІ) сульфат NiSO4 — зелений; кобальт(ІІ) сульфат CoSO4 — рожевий.
Розчинність є важливою характеристикою солей, вона дуже різноманітна. Є солі розчинні, малорозчинні та практично нерозчинні у воді. Наприклад, усі солі Натрію та Калію, а також усі нітрати добре розчинні. Серед силікатів, карбонатів, сульфітів, фосфатів і сульфідів переважна більшість солей — нерозчинні у воді, наприклад: FeSiO3, CrPO4.
Встановити розчинність солей у воді можна за Таблицею розчинності.
Таблиця розчинності основ, кислот, амфотерних гідроксидів і солей у воді за температури 20—25 0C
Смак не є фізичною властивістю, і кожен знає, що речовини на смак у лабораторії пробувати не можна. Відомо, що алхіміки, досліджуючи властивості речовин, випробували їх на смак. Інколи це закінчувалось трагічно. Все ж встановлено, що серед солей солоний смак мають лише кухонна сіль, калій хлорид і натрій сульфат, інші — гіркі або змішаних смаків. Солодкими на смак є солі Берилію та Плюмбуму, але ці солі отруйні.
Хімічні властивості середніх солей
1. Взаємодія розчинів солей із металами.
Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в реакціях між металом і сіллю тільки активніший метал витіснить менш активний. Наприклад, якщо мідну монету покласти в розчин меркурій (II) нітрату, вона поступово покривається шаром ртуті, а мідь переходить в розчин:
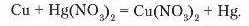
ВЗАЄМОДІЯ МЕТАЛІВ ІЗ СОЛЯМИ У ВОДНОМУ РОЗЧИНІ
Порівнявши активність металів, що вступають у реакцію, і тих, які входять до складу солей, можна зробити висновок: реакція відбувається тоді, коли метал є більш активним за той, що входить до складу солі.
Рівняння реакцій:
2. Взаємодія солей з кислотами
Водні розчини солей реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота. Якщо до розчину нагрій
карбонату долити хлоридпої кислоти, то відбувається бурхливе виділення газу. Це свідчить проте, що реакція відбулася.
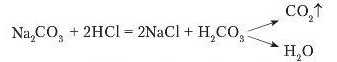
Однак не тільки карбонати взаємодіють з кислотами з виділенням газу. Під час доливання до розчину калій сульфіту нітратної кислоти теж спостерігається виділення газу. Це сульфур(ІV) оксид.
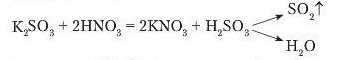
Як вам відомо, реакції відбуваються, коли під час їх перебігу випадає осад. Візьмемо розчин барій хлориду й подіємо розчином сульфатної кислоти. Спостерігається випадання білого осаду.
BaCl2 + H2SO4 =BaSO4 + 2HCl
Вам уже відома реакція між аргентум нітратом і хлоридною кислотою. Під час цієї реакції випадає білий сирнистий осад.
AgNO3 + HCl = AgCl +HNO3
Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:
1) утворюється нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. У результаті реакції виділяється газ;
2) випадає нерозчинний у кислотах осад.
3. Взаємодія солей із лугами.
Na2SO4+ Ba(OH)2 = BaSO4+ 2NaOH.
Утворюється білий осад барій сульфату. Якщо до останнього долити кислоти, то осад не розчиняється.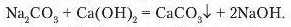
Знову ж таки випав білий осад, який за доливання кислоти розчиняється.
Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидом.
Інтерактивна вправа. Перегляньте відео Хімічні властивості солей
4. Взаємодія розчинів солей між собою.
Розчинні у воді солі вступають у реакції обміну.
Лабораторний дослід 9. РЕАКЦІЯ ОБМІНУ МІЖ СОЛЯМИ В РОЗЧИНІ
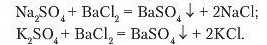
Зверніть увагу на те, що солі вступають у реакції обміну між собою тільки в розчинах.











