Кислоти - це складні речовини, які складаються з атомів Гідрогену, здатних заміщуватися на атоми метали, та кислотних залишків.
Назви кислотних залишків відповідають назвам кислот, якщо забрати закінчення -на.
Назви кислот та кислотних залишків
 Виконайте інтерактивну вправу Тренажер "Назви кислот"
Виконайте інтерактивну вправу Тренажер "Назви кислот"Кислоти класифікують за: вмістом атомів Гідрогену (одноосновні, двоосновні. триосновні)та за вмістом Оксигену (оксигеновмісні й безоксигенові).
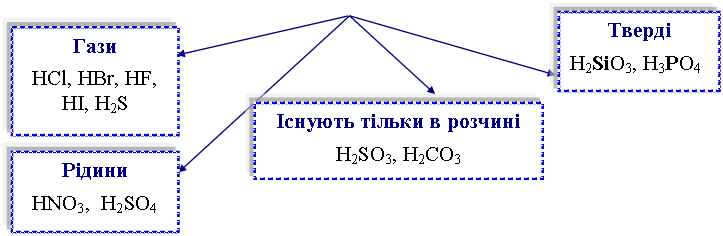
Фізичні властивості кислот.
За агрегатним станом:
Під час роботи з кислотами необхідно дотримуватися правил техніки безпеки!
|
Хімічні властивості кислот
1. Зміна забарвлення індикаторів.
Віртуальний лабораторний дослід 2. ДІЯ РОЗЧИНІВ КИСЛОТ НА ІНДИКАТОРИ
Досліджуємо, як діють кислоти па індикатори. Зверніть увагу, чи всі індикатори можна використовувати для виявлення кислот у розчинах.
Фенолфталеїн не змінює забарвлення в кислому середовищі. Усі інші індикатори (лакмус, метиловий оранжевий, універсальний індикаторний напір) набувають червоного забарвлення різних відтінків.
2. Взаємодія кислот з металами.
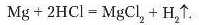
Аналогічно виділення водню спостерігається, якщо до гранул цинку долити розчину сульфатної кислоти (рис. 69):
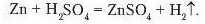
- Реакції заміщення — це реакції, що відбуваються між простою і складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Віртуальний лабораторний дослід З. ВЗАЄМОДІЯ ХЛОРИДНОЇ КИСЛОТИ З МЕТАЛАМИ
Це дослідження показує, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у внтискувальиий ряд металів.
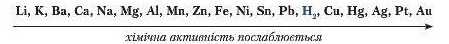
Виявлено, що метали, розташовані в ряді до водню, мають здатність витискувати його з кислот, утворюючи просту речовину водень (виняток нітратна кислота). П'ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тин реакцій називають реакціями заміщення.
Реакції заміщення це реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Окрім водню, під час реакції утворюється сіль відповідного металу.
3. Взаємодія кислот з основними оксидами.
Як приклади таких хімічних перетворень можна навести рівняння реакцій:
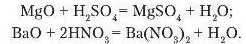
Реакції обміну - це реакції між двома складними речовинами, під час яких вони обмінюються складовими частинами.
4. Взаємодія кислот з основами
Кислоти взаємодіють з основами, при цьому утворюється сіль та вода.
Взаємодія кислот з оновами з утворенням солі та води називається реакцією нейтралізації.
Реакція нейтралізації належить до реакції обміну.
NaOH+HCl=NaCl+H20
Cu(OH)2+ H2SO4 = CuSO4 + H2O
Приклади реакцій нейтралізації:
Са(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)2 +6H2O
5. Взаємодія кислот з солями
Кислотам властиво взаємодіяти з розчинами солей. Реакції між ними відбуваються за умови, якщо спостерігається:
а) випадання осаду;
б) виділення газу;
в) одним із продуктів реакції є вода.
Розглянемо приклад цієї реакції за допомогою відеодемонстраційного досліду.
CaCO3 + 2HCl = CaCl2 + H2O +CO2
K2S + 2HCl = 2KCl + H2S
Na2SO3 + H2SO4 = Na2SO4 +H2O + SO2
Виконай інтерактивну вправу Витискувальний ряд кислот