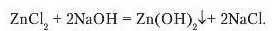Почнемо традиційно з розминки!
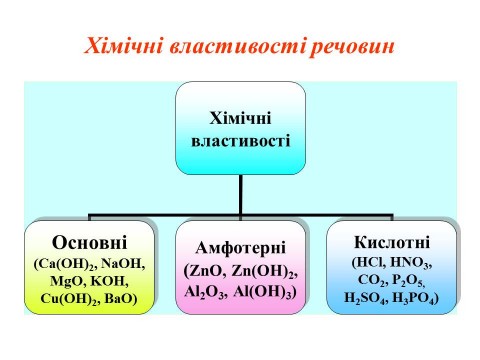
Як бачимо, основи і основні оксиди мають основні властивості, кислоти і кислотні оксиди мають кислотні властивості. При цьому, виділяють ще групу речовин, які проявляють проміжні властивості - мають ознаки кислот та основ. Їх називають амфотерними.
Амфотерні гідроксиди — речовини, до складу яких входить аніон ОН− (гідроксид-іон), і які при взаємодії з кислотами поводять себе як основи, а при взаємодії з основами — як кислоти. До амфотерних відносять гідроксиди, формально утворені від амфотерних оксидів: Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Sn(OH)4, Pb(OH)4 тощо.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов виявляти або основні, або кислотні властивості. Наприклад, з кислотами гідроксиди Алюмінію та Цинку реагують як основи, з лугами - як кислоти.

Амфотерні гідроксиди
|
Амфотерний гідроксид |
Кислотний залишок і його валентність |
|
|
основна форма |
кислотна форма |
|
|
Zn(OH)2 |
H2ZnO2 |
ZnO2 (II) |
|
Al(OH)3 |
HAlO2 (H3AlO3 - H2O = HAlO2) |
AlO2 (I) |
|
Be(OH)2 |
H2BeO2 |
BeO2 (II) |
|
Sn(OH)2 |
H2SnO2 |
SnO2 (II) |
|
Pb(OH)2 |
H2PbO2 |
PbO2 (II) |
|
Fe(OH)3 |
HFeO2 (H3FeO3 - H2O = HFeO2) |
FeO2 (I) |
|
Cr(OH)3 |
HCrO2 (H3CrO3 - H2O = HCrO2) |
CrO2 (I) |
Фізичні властивості амфотерних гідроксидів.
Амфотерні гідроксиди це тверді речовини немолекулярної будови. Нерозчинні у воді. Мають різне забарвлення: цинк та алюміній гідроксиди — білого кольору, ферум(ІІІ) гідроксид бурого.
Хімічні властивості амфотерних гідроксидів.
1. У розчинах амфотерних гідроксидів індикатори не змінюють свого забарвлення. Вони дуже слабкі електроліти. Не випадково ці гідроксиди віднесені до нерозчинних основ.
2. Амфотерні основи розчиняються в кислотах:

3. Амфотерні основи взаємодіють з лугами:
а) тверді луги взаємодіють з амфотерними основами при сплавлянні:

Однак можливе утворення і солей — ортоалюмінатів:

б) у розчинах лугів утворюються комплексні солі:

або при надлишку лугу:

Щоб побачити особливі відмінності амфотерних сполук, проведемо досліди!
Реакція взаємодії амфотерних гідроксидів із кислотами відбувається як взаємодія типової нерозчинної основи з кислотою. Результатом цієї реакції є сіль та вода.
Щоб краще зрозуміти суть реакції, формулу цинк гідроксиду видозмінимо. На першому місці розташуємо атоми Гідрогену, а групу атомів ZnO2, поставимо за Гідрогеном. Формула матиме вигляд H2ZnO2. Реакція спостерігається краще, якщо до певної порції розчину лугу приливати цинк гідроксид.
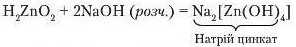
Така ж реакція відбувається й між твердими речовинами за високих температур. Наприклад:
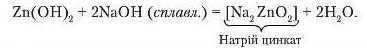
Напишемо рівняння реакції взаємодії алюміній гідроксиду з калій гідроксидом у розчині та під час сплавлення:
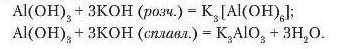
Отже, цинк гідроксид та алюміній гідроксид амфотерні.
Потренуйтесь у складанні рівнянь хімічних реакцій
Закріплюйте отримані знання! Дивіться ролик!
Виконуйте вправу у зошиті!
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Амфотерність — це здатність речовин проявляти подвійні хімічні властивості (основних і кислотних оксидів, основ і кислот).
• Амфотерні гідроксиди — тверді речовини немолекулярної будови. Нерозчинні у воді. Мають різне забарвлення.
• Амфотерні гідроксиди проявляють подвійну хімічну природу: під час реакцій з кислотами — як основи, а з лугами — як кислоти.
• Амфотерні гідроксиди реагують з кислотами й лугами в розчинах та під час спікання. Продуктами реакцій є солі.
Подивись ще й тут!!!! Це цікаво!!