Цей відомий закон Ома
Цей відомий закон Ома
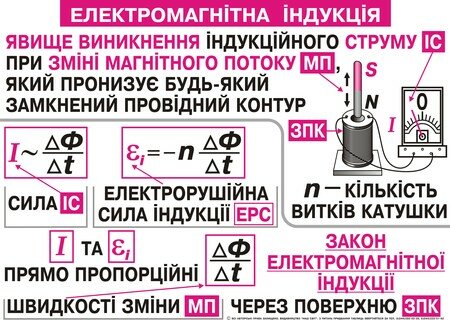
Одним із найвідоміших законів фізики є, безперечно, закон Ома. Цей закон часто зустрічається як в народних прислів"ях так і в численних кросвордах. Напевне, у 1826 р. Г.Ом експериментально встановивши співвідношення між струмом та напругою навіть і не здогадувався про цю славу. Проте не всі пам"ятають про чотири різних формулювання цього закону для електричних кіл із постійним струмом.
1. Закон Ома для однорідної ділянки кола.
Сила струму І в однорідній ділянці кола прямо пропорційна напрузі, яку прикладено до ділянки і обернено пропорційна характеристиці ділянки, яку називають електричним опором провідника ( рис. 1 ).
Пам"ятаємо, що опір провідника R визначає його здатність обмежувати силу струму в колі і пов"язаний ( в металах ) з розсіюванням електронів провідності на теплових коливаннях кристалічної решітки та структурних неоднорідностях.
2. Закон Ома для замкнутого кола.
Сила струму в замкнутому колі прямо пропорційна Е.Р.С. джерела і обернено пропорційна сумі зовнішнього і внутрішнього опорів 
Електрорушійною силою джерела ( Е.Р.С. ) називається фізична величина, яка вимірюється роботою джерела струму при переміщенні одиничного додатнього заряду замкнутим колом.
 |
| Мал 1. Електроліз водного розчину хлориду міді. |
Електролітами називають провідні середовища, в яких протікання електричного струму супроводжується перенесенням речовини.
- Носіями вільних зарядів в електролітах є додатньо і від’ємно заряджені іони.
- До електролітів відносяться водні розчини кислот, солей і лугів а також розплави деяких твердих речовин.
- Проходження струму крізь електроліт супроводжується виділенням речовини на електродах. Це явище називають електролізом.
Електричний струм в електролітах представляє собою переміщення іонів обох знаків в протилежних напрямах. Додатні іони рухаються до від’ємного електрода (катода), від’ємні іони – до додатного електрода (анода). Іони обох знаків з’являються в водних розчинах солей, кислот і лугів в результаті розчеплення частини нейтральних молекул. Це явище називають електролітичною дисоціацією.
- При підключенні електродів до джерела струму іони під дією електричного поля починають впорядкований рух: додатні іони міді рухаються до катода, а від’ємні йони хлору – до анода (мал.1).
- Досягнувши катода, іони міді нейтралізуються надлишковими електронами катода і перетворюються в нейтральні атоми, які виділяються (осідають) на катоді. Йони хлору, досягнувши анод, віддають по одному електрону. Після цього нейтральні атоми хлору з’єднуються попарно і утворюють молекули хлору Cl2. Хлор виділяється на аноді в виді бульбашок газу.
Отже, при проходженні електричного струму крізь електроліт на електродах виділяється речовина (в нашому прикладі мідь і хлор).
- Закон електролізу був експериментально встановлений англійським фізиком М. Фарадеєм в 1833 році. Закон Фарадея визначає масу речовини, яка виділяється на електродах під час електролізу:
Маса m речовини, яка виділяється на електроді, прямо пропорційна заряду Q, який пройшов крізь електроліт:
m = kQ = kIt.
- Маса речовини, яка виділиться на електроді дорівнює масі всіх іонів, які прийшли на електрод:
- Отже, електрохімічний еквівалент k дорівнює відношенню маси іона m0 до його заряду q0.
- Оскільки заряд іона дорівнює добуткові валентності речовини z на елементарний заряд e (q0 = z∙e), то вираз для електрохімічного еквівалента k можна записати так:
- Закон Фарадея для електролізу можна записати так:
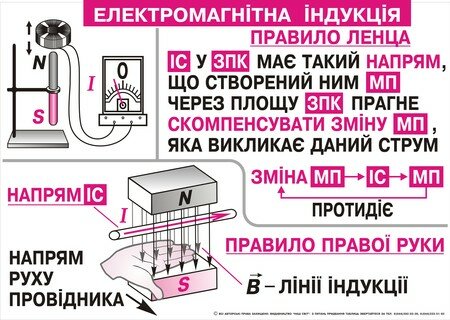
| Магнітне поле: силові лінії. |